- Artículo
- Fuente: Campus Sanofi
- 10 oct 2023
Fase III MELODY: Estudio ▼Beyfortus en lactantes prematuros
En los recién nacidos a término y prematuros tardíos, Beyfortus® redujo el riesgo de ITRI por VRS AM, incluidas las hospitalizaciones, en un 74,5%1,2
Diseño del estudio
Ensayo multicéntrico de fase III aleatorizado, doble ciego y controlado con placebo. La población del estudio incluyó 1490 lactantes a término y prematuros tardíos (EG ≥35 semanas) que iniciaban su primera temporada. Los lactantes fueron aleatorizados 2:1 para recibir una dosis intramuscular única de 50 mg de Beyfortus® si pesaban <5 kg o 100 mg de Beyfortus ® si pesaban ≥5 kg en el momento de la administración (n=994) o placebo (n=496).1,2
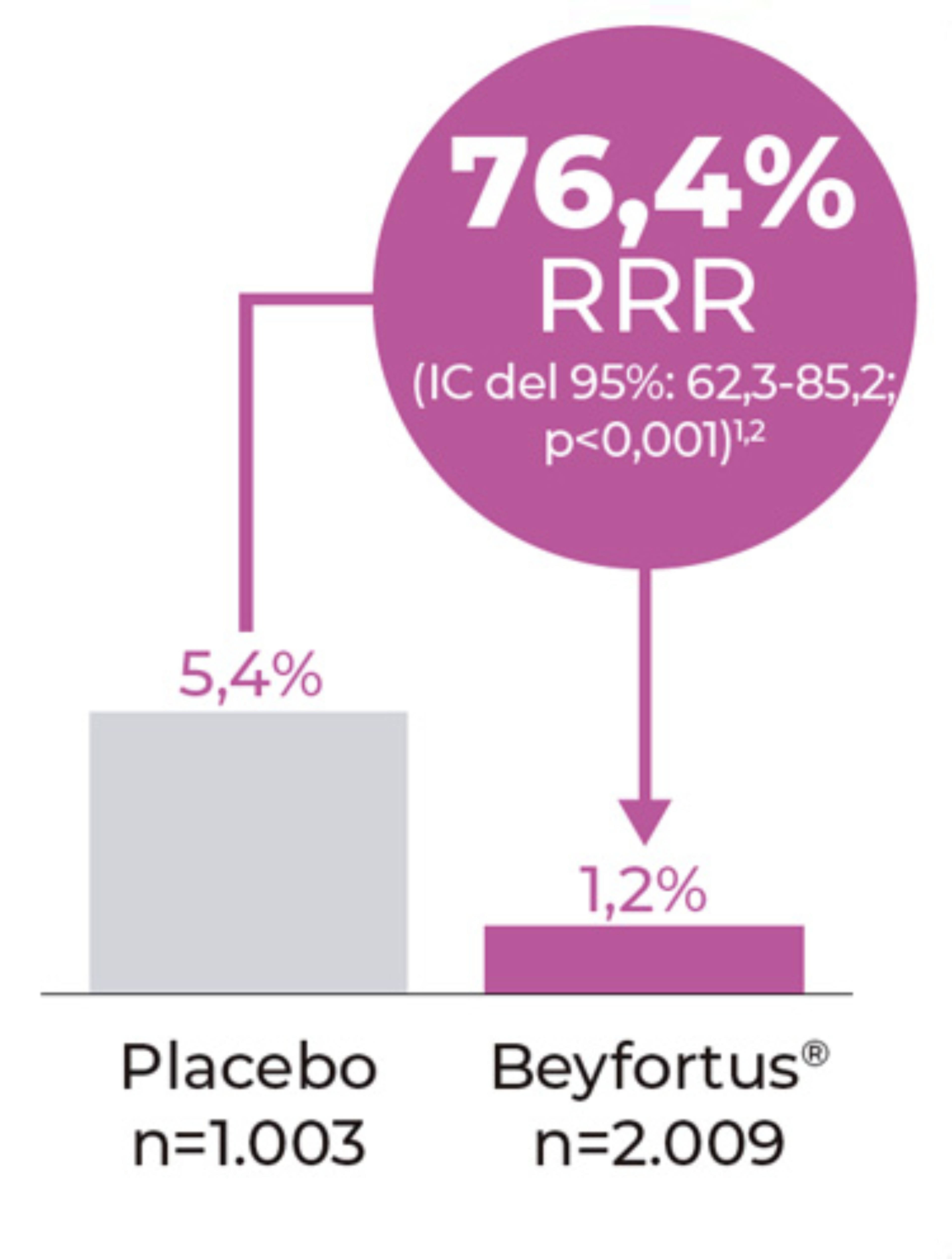
Criterio principal de valoración
Incidencia de ITRI AM (en hospital o ambulatorios) causada por VRS confirmado mediante RT-PCR hasta 150 días después de la inyección.1,2
Extraido de Muller WJ et al. 2023.
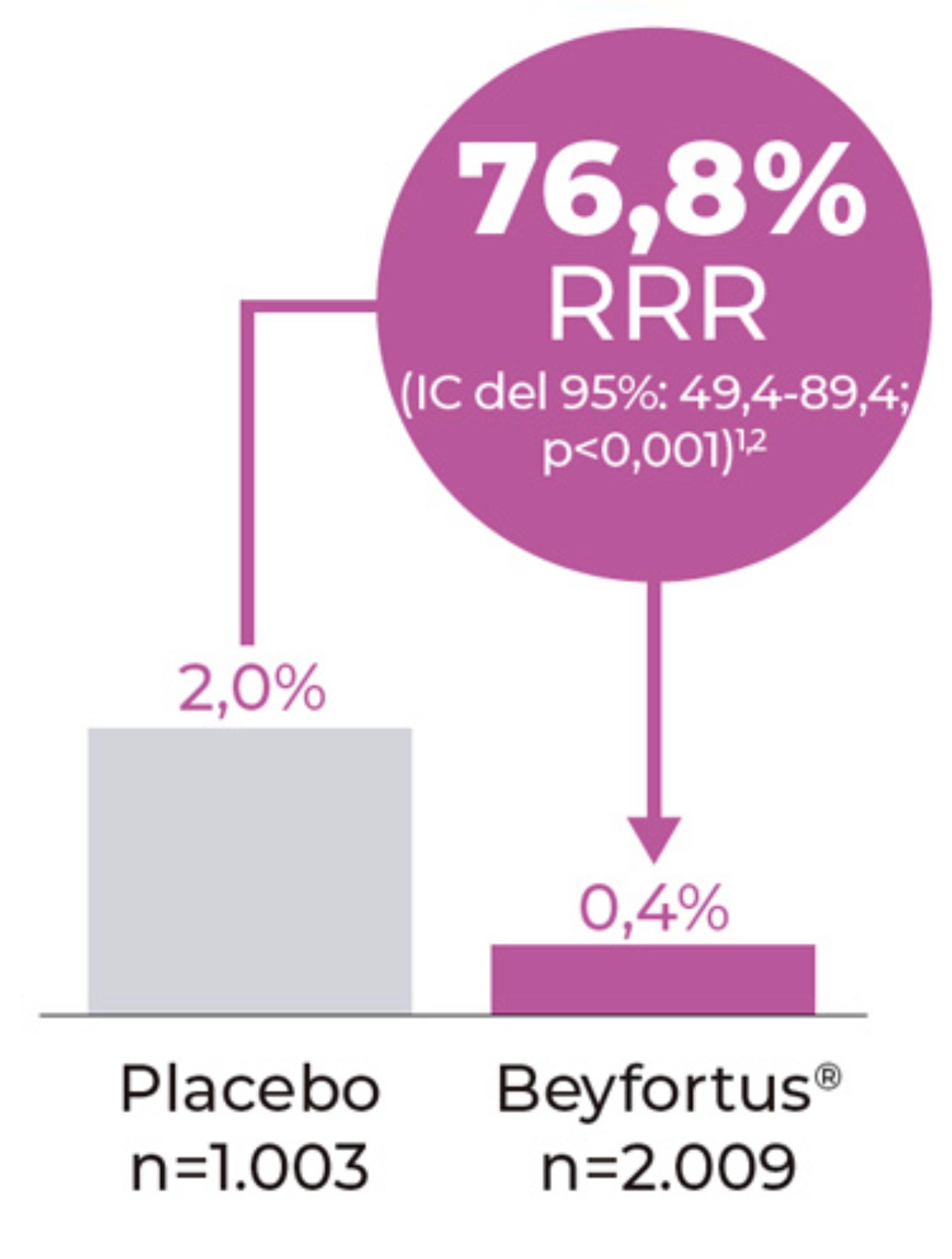
Criterio de valoración secundario
Incidencia de hospitalización de ITRI por VRS hasta 150 días después de la inyección.1,2
Extraido de Muller WJ et al. 2023
En este estudio se realizó un análisis exploratorio para cuantificar la reducción de ITRI por cualquier causa.2
- 38,2% RRR de ITRI por cualquier causa hasta el día 150 vs. placebo (IC del 95%: 23,7-50,0). La incidencia fue del 8,5% con Beyfortus® vs. 13,9% con placebo.2
- 38,9% RRR de hospitalización por ITRI por cualquier causa hasta el día 150 placebo (IC del 95% 6,3-60,2). La incidencia fue del 2,2% con Beyfortus® vs. 3,7% con placebo.2
Los tipos y frecuencias de las reacciones adversas fueron similares en los grupos de Beyfortus® y placebo.2
De acuerdo con la ficha técnica, la reacción adversa más frecuente fue la erupción (0,7 %) que se produjo en los 14 días posteriores a la dosis. La mayoría de los casos fueron de intensidad leve a moderada. Además, se notificaron pirexia y reacciones en el lugar de la inyección en una tasa de 0,5 % y 0,3 % dentro de los 7 días posteriores a la dosis, respectivamente.1
En lactantes prematuros 29-35 semanas, Beyfortus® (Nirsevimab) redujo el riesgo de ITRI por VRS atendida médicamente (AM), incluidas las hospitalizaciones, en un 70,1%.1,3
Contenido mínimo de Beyfortus®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y PRESENTACIÓN
BEYFORTUS® 50 mg SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA, 1 jeringa precargada (CN: 762403) y BEYFORTUS® 100 mg SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA, 1 jeringa precargada (CN: 762405) PVP notificado: 812,67 € PVP IVA notificado: 845,18 €. Financiada por el SNS. Con receta.
Ficha Técnica Beyfortus® 50mg Ficha Técnica Beyfortus® 100 mg
▼ «Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas de reacciones adversas asociadas a este medicamento.»
IC, intervalo de confianza; EG, edad gestacional; ITRI, infección del tracto respiratorio inferior AM, médicamente atendido; RRR, reducción del riesgo relativo; VRS, Virus Respiratorio Sincitial; RT-PCR, reacción en cadena de la polimerasa con transcripción reversa.
Referencias
- Ficha técnica https://cima.aemps.es/cima/dochtml/ft/1221689004/FT_1221689004.html Acceso Junio 2023
- Muller WJ, et N Engl J Med. 2023 Apr 20;388(16):1533-1534
- Griffin MP et al. N Engl J Med 2020; 383(5): 415–425
MAT-ES-2400638 V1 Febrero 2024